Was sind Biosimilars?



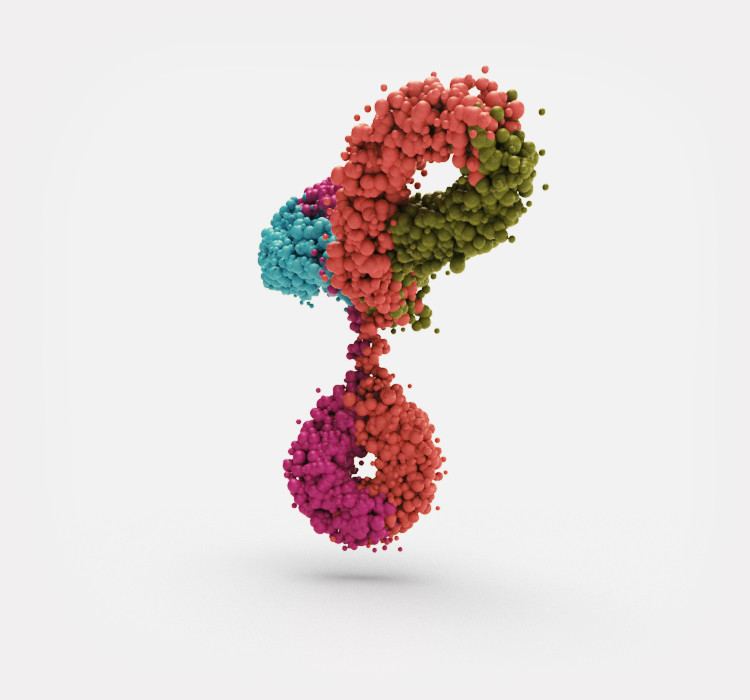






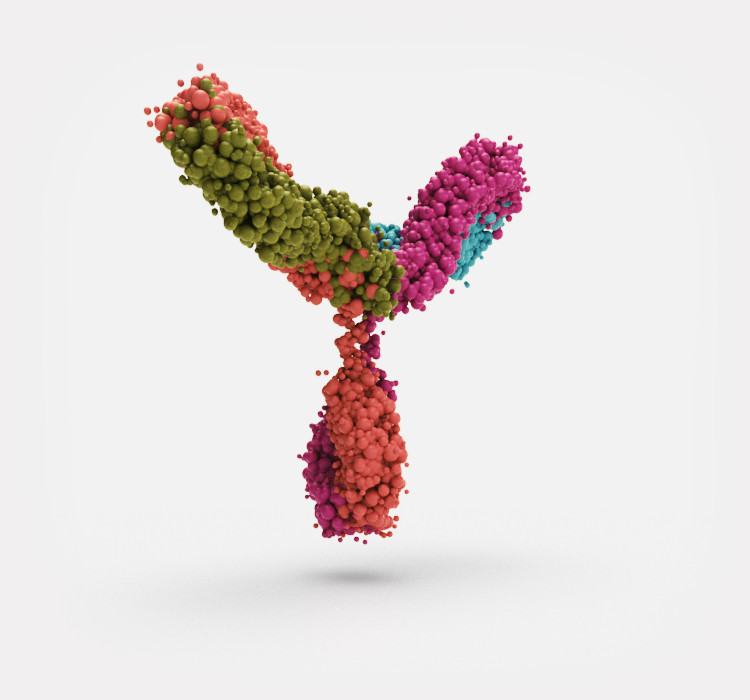




















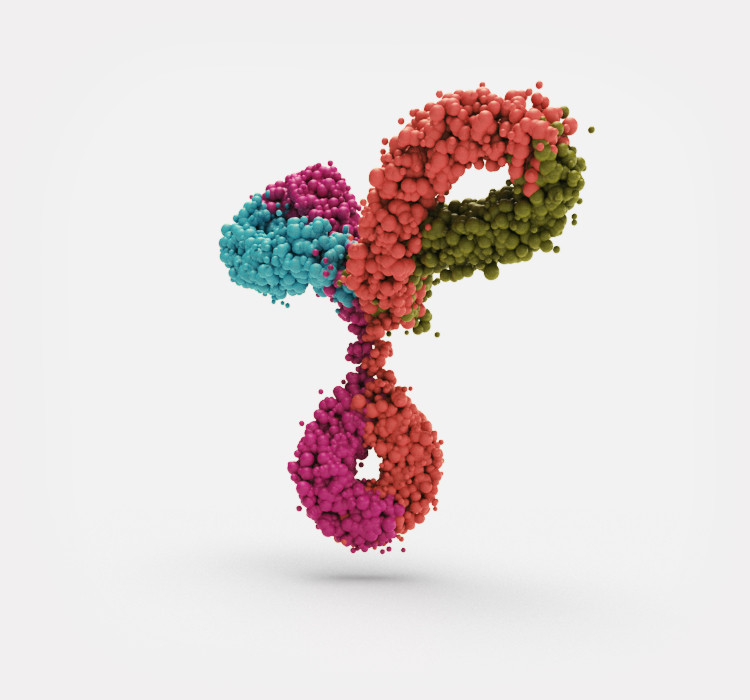

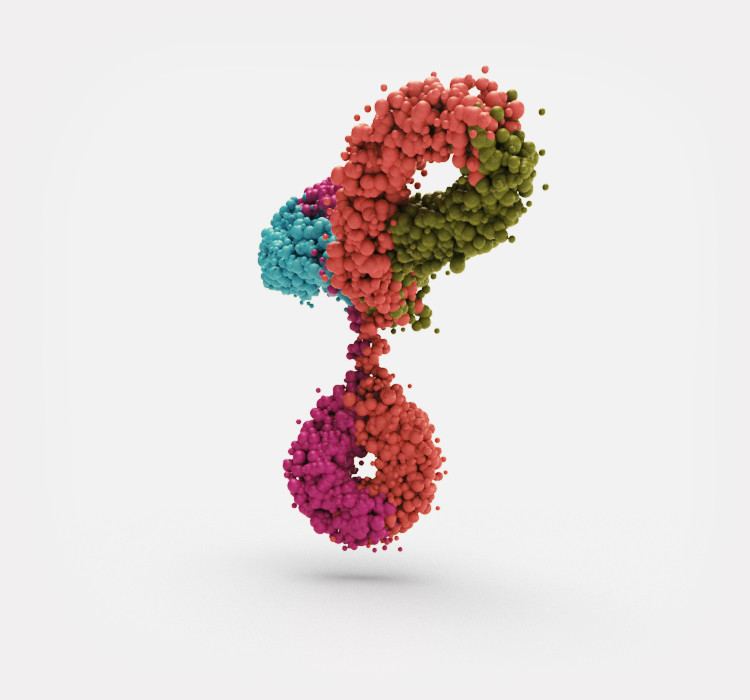






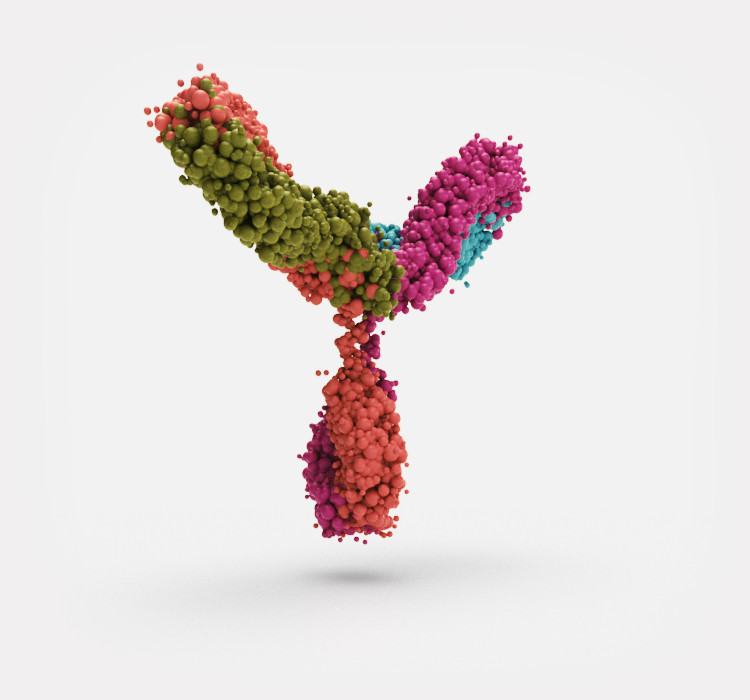





























Biosimilars sind Nachahmerprodukte sogenannter Biologika, das heißt biotechnologisch hergestellter Medikamente, die nach Patentablauf der Originale auf den Markt gebracht werden können.
5 wissenswerte Fakten über Biosimilars
- Biosimilars sind Nachbildungen bereits zugelassener biotechnologisch hergestellter Arzneimittel, deren Patentschutz ausgelaufen ist.
- Jedes zugelassene Biosimilar ist vergleichbar verträglich und wirksam wie das Originalprodukt.
- Insgesamt können bis zu 5.000 Herstellungsschritte in einem Zeitraum von ca. zwei Jahren für die Entwicklung des Moleküls eines Biosimilars nötig sein. Die Gesamtentwicklungsdauer bis zur Zulassung beträgt ca. acht Jahre.
- Biosimilars können mehr Patient:innen den Zugang zu modernen Arzneimitteln ermöglichen.
- Biosimilars können einen wichtigen Beitrag zu einer qualitativ hochwertigen und modernen Versorgung von Patient:innen in bedeutenden Therapiegebieten leisten.
Biosimilars – Eine Definition
Biosimilars sind Nachahmerprodukte bereits zugelassener biologischer Arzneimittel, den Biologika oder Biopharmazeutika. Sie werden zur Therapie einer großen Bandbreite von Erkrankungen verwendet. Sowohl Original-Biologika als auch Biosimilars werden nicht wie klassische Arzneimittel und ihre Kopien (Generika) chemisch, sondern in lebenden Organismen hergestellt.
Läuft das Patent der Original-Medikamente aus, verliert die herstellende Pharmafirma damit die Exklusivitätsrechte an diesem Wirkstoff. Somit können andere Unternehmen entsprechende Nachbildungen, die Biosimilars, auf den Markt bringen. Diesen Prozess gibt es in ähnlicher Weise auch bei den chemisch hergestellten Medikamenten, von denen, nach Ablauf des Patentschutzes, sogenannte Generika erhältlich sind.
Was ist der Unterschied zwischen Biosimilars und Generika?
Bei herkömmlichen Wirkstoffen handelt es sich um sehr kleine Moleküle. Diese sogenannten „small molecules“ können mit einfachen chemischen Methoden hergestellt werden. Dies betrifft auch ihre Kopien, die Generika. Biosimilars sind dagegen sehr komplexe, deutlich größere Wirkstoffe, wie zum Beispiel Hormone oder monoklonale Antikörper. Sie müssen biologisch in lebenden Zellen hergestellt werden. Dazu verwendet man zum Beispiel bestimmte gentechnisch veränderte Bakterien- oder Hefezellen. Diese Herstellungsverfahren sind sehr aufwändig und empfindlich gegenüber Umweltfaktoren wie Änderungen der Temperatur oder der Zusammensetzung des Nährmediums, in dem die Zellen wachsen. Daher erfordern sie eine ständige aufwändige Qualitätskontrolle des Produkts.

Sind Biosimilar und Original identisch?
Prinzipiell sind Biosimilars und Originalprodukte, die so genannten Referenzarzneimittel, von der Struktur her miteinander vergleichbar. Aufgrund ihres komplexen Aufbaus und ihrer Größe kann es aber immer geringe Unterschiede bei den Produkten geben. Eine exakte Reproduktion ist nicht oder kaum möglich. Dabei treten Unterschiede nicht nur vom Referenzarzneimittel zum Biosimilar, sondern sogar zwischen verschiedenen Produktionschargen des Referenzarzneimittels auf. Diese Abweichungen dürfen aber keinerlei Auswirkungen auf Wirksamkeit und Verträglichkeit des Produkts haben und sich nur innerhalb genau definierter, enger Grenzen bewegen.
Damit das neue Biosimilar zugelassen wird, muss daher zunächst nachgewiesen werden, dass es dem Referenzarzneimittel so ähnlich wie möglich ist. Daher leitet sich auch der Begriff „similar“, englisch für „ähnlich“, ab. In Europa erfolgt die Zulassung von Biosimilars durch die Europäische Arzneimittelagentur (EMA). Diese hat ein umfangreiches Zulassungsverfahren festgelegt, in dem Expert:innen die vom Hersteller zur Verfügung gestellten Daten zu Qualität, Wirksamkeit und Unbedenklichkeit dieser Arzneimittel prüfen, bevor sie auf den Markt gebracht werden dürfen. Diesem Verfahren liegen intensive analytische Untersuchungen, präklinische Tests und anschließende klinische Studien zugrunde.
Hat ein Biosimilar schließlich die Zulassung erhalten, bedeutet dies, dass es hinsichtlich seiner Wirkung und Verträglichkeit mit dem Originalprodukt gleichwertig ist und damit eine vollwertige Therapiealternative bietet. In der Regel kann es in derselben Dosierung zur Behandlung derselben Krankheiten verwendet werden wie das Referenzarzneimittel.
Breiter Einsatz von Biosimilars
Nachdem in den frühen 1980er Jahren erstmals biologische Arzneimittel in der Europäischen Union zugelassen wurden, nahm ihre Bedeutung im Laufe der Jahre immer weiter zu. 2001 begannen nach und nach die Patente einiger wichtiger Biologika auszulaufen. In der Folge wurde 2006 das erste Biosimilar für die Behandlung von Wachstumsstörungen zugelassen¹. Mit Stand Mai 2022 gibt es 71 in der EU zentralisiert zugelassene Biosimilars in 18 verschiedenen Wirkstoffgruppen², die in ihrer Wirkung und Verträglichkeit den Originalpräparaten in nichts nachstehen.
Biosimilars bieten großes Potential für eine bessere Patientenversorgung
Die Herstellung biologischer Arzneimittel erfordert hohe finanzielle und zeitliche Investitionen in Forschung und Entwicklung sowie in die anschließende Produktion und ständige Qualitätskontrolle der Wirkstoffe. Daher handelt es sich bei Biologika um sehr hochpreisige Arzneimittel.
Biosimilars bauen auf den wissenschaftlichen Erkenntnissen, die bezüglich des Referenzarzneimittels bereits gewonnen wurden, auf. Dies heißt, dass nicht alle klinischen Studien, die mit dem Originalprodukt durchgeführt wurden, wiederholt werden müssen. Für die Hersteller bedeutet das eine enorme Zeit- und Kostenersparnis. Dennoch ist die Entwicklung und Herstellung aufwändiger und teurer als bei Generika, da die Wirkstoffmoleküle deutlich komplexer und größer sind und entsprechend ein aufwändiger Entwicklungs- und Herstellungsprozess dahinter steht. Während die Entwicklungsdauer bei Generika etwa zwei Jahre beträgt, sind es bei Biosimilars bis zu acht Jahre.
Mit Biosimilars kann in der Regel ökonomischer verordnet werden als mit Original-Biologika und Patient:innen der Zugang zu einer Therapie mit biologischen Wirkstoffen erleichtert werden. Biosimilars haben daher ein hohes Potential, Kosten im Gesundheitssystem einzusparen und zu einer qualitativ hochwertigen und modernen Versorgung von Patient:innen in bedeutenden Therapiegebieten beizutragen.
¹ Arbeitsgemeinschaft Pro Biosimilars des Pro Generika e.V.: Handbuch Biosimilars 2019. September 2019, Berlin.
² vfa bio. Übersicht über zentralisiert in der EU zugelassene Biosimilars (Stand 06.05.2022). https://www.vfa.de/de/arzneimittel-forschung/datenbanken-zu-arzneimitteln/biosimilars-uebersicht. Zugriff am 04.08.2022.